

Doctor Irving H. Rosemberg MD Universidad de Harvard – Internista y Gastroenteròlogo, Actualmente Profesor de la Universidad Jean Mayer de la Universidad de Tufts, Profesor de Nutrición de la escuela Frietman de Nutrición, Cientìfico Senier y Director Interino del Laboratorio de Neurociencias y Envejecimiento. irwin.rosenberg@tufts.edu
En 1931, Critchley señaló que la pérdida de músculo se produce con el
envejecimiento y es más notable en los músculos intrínsecos de la mano y del
pie. El término Sarcopenia viene del griego: “sarx” o carne y “penia” o pérdida, acuñado originalmente por el doctor en medicina de la Universidad de Harvard y profesor de la universidad de Tufts de la ciudad de Boston Irwin Rosemberg en el año 1989.
Esta nueva condición física o estado clínico ha sufrido diferentes consideraciones en su corto tiempo de existencia y es así como los grupos que la investigan proponen parámetros de diagnóstico diferentes desde la medición de la cantidad de músculo hasta la cuantificación de la calidad del mismo.

Doctora Marjolein Visser, Nutricionista, Profesora de la Universidad de Amsterdam, Holanda.
En 1996 la dra. Visser participó en estudios multicèntricos determinando la masa muscular esquelética mediante la medición del área de sección
transversal de las piernas utilizando resonancia magnética, encontrando una relación directa entre el envejecimiento y la infiltración grasa del músculo. (1)
El estudio EPIDOS (EPIDemiologie de l’OSteoporose study) de 2014 resumió 6
diferentes definiciones de Sarcopenia, tres de ellas empleando únicamente lamedición de la cantidad de masa muscular, dos definiciones emplearon la cantidad de masa muscular y la velocidad de marcha y solamente una definición utilizó la cantidad de masa muscular, la velocidad de marcha y la fuerza de agarre. Ellas fueron:(2).

Doctor Richard N Baumgartner PhD in Nutritional Epidemiology from University of Texas (1982). The principal investigator in “New Mexico aging process study” (1998-2004). Actualmente Profesor de epidemiología de la Universidad Lousville. Kentucky.
En 1998 el profesor Richard Baumgartner investigador principal en el “Proceso de envejecimiento” de la Universidad de Nuevo México, utilizó el Índice de masa muscular apendicular -IMMA – para cuantificar la cantidad de masa mediante un corte arbitrario de la masa muscular en las extremidades calculado con DXA (Absorciometría dual de rayos X) y dividiéndolo sobre la talla al cuadrado, como único parámetro diagnóstico. Propuso los primeros puntos de corte para este IMMA.
Bajo este medio Baumgartner fue el primero en determinar la prevalencia de
la “Sarcopenia” en mayores de 60 años tanto en hombres como en mujeres.

Doctora Anne B. Newman MD Geriatra y Salubrista del Geriatric of Presbyterian University Hospital, Pittsburgh. Public Health Public. Pensilvania.
Para el año 2003 la doctora Anne B. Newman propuso el empleo de
percentiles de la masa muscular apendicular establecido mediante DXA
como único parámetro diagnóstico. Definición de Sarcopenia utilizando
el método de los residuos.

Doctor Mattew J. Delmonico Kinesiologia y Ph en Epidemiología. Profesor asociado de la Universidad de Rhode Island.
En el 2007 el profesor Mattew J. Delmonico utilizó el índice de masa muscular apendicular IMMA al igual que Baumgartner.
Propuso un punto de corte diferente en el IMMA para el diagnóstico de sarcopenia, teniendo en cuenta que incluyó en sus estudios personas obesas y más jóvenes.

Doctor Alfonso J. Cruz-Jentoft Médico geriatra de la Universidad Complutense de Madrid. Director de la unidad de geriatría del Hospital Ramón y Cajal. Madrid.
En el 2010 el doctor Alfonso Cruz-Jentof quien hace parte “The European
Working Group on Sarcopenia in Older People” (EWGSOP), utiliza los criterios de medición de la masa muscular del doctor Baumgartner con los puntos de corte para el IMMA, combinándolo con la velocidad de marcha y la fuerza de agarre.

Doctor Maurizio Muscaritoli Médico internista –Nutricionista. Profesor Universidad de Roma. Italia.
En el 2010 el doctor Maurizio Muscaritoli, quien hace parte del “Special
Interest Group of the European Sarcopenia Working Group” emplea los
criterios de medición de la masa muscular del doctor Baumgartner con los
puntos de corte para el IMMA, y le suma la velocidad de marcha.

Educador Físico Roger Fielding Ph en Nutrición Clínica y profesor de la Universidad de Tuft, Boston.
En el 2011 el Profesor Roger Fielding quien hace parte del “International
Workinig Group on Sarcopenia” emplea los criterios de medición de la masa
muscular del profesor Delmonico con sus puntos de corte para el IMMA y le
añade la velocidad de marcha.

Doctor Kim Tae Nyum Médico Internista Universidad de Busan. Corea.
Al mismo tiempo el doctor Kim Tae Nyum del Centro de enfermedades
metabólicas y endocrinas de la Universidad de Busan en Corea propone otros
puntos de corte para el cálculo de la masa muscular apendicular medido con
DXA teniendo en cuenta que utilizó población coreana.
Es así como hasta la fecha las investigaciones tendientes a definir el proceso de pérdida muscular no permiten unificar la definición de sarcopenia y mucho menos a establecer su método diagnóstico, haciendo necesario su estudio, proceso diagnóstico y terapéutico de manera regional y particular.
En el año 2008 la Sociedad de Medicina Geriátrica de la Unión Europea – EUGMS – junto con la Asociación Internacional de Geriatría – IAGG – con sede en Corea y la Sociedad Europea de Nutrición clínica y Metabolismo propusieron la creación de una mesa de trabajo en sarcopenia dando origen a la European working group on sarcopenia in older people. Posteriormente en el año 2010 la EUGMS crea en su interior un grupo especial de trabajo en sarcopenia, al mismo tiempo que en los Estados Unidos se da origen a otro grupo de estudio de la sarcopenia.
En la actualidad existen tres grandes grupos trabajando en la “Sarcopenia”,
ellos son:
The European Working Group on Sarcopenia in Older People
(EWGSOP)reconocido desde el año 2008 con sede en Madrid y liderado por el Dr. Alfonso Cruz-Jentof, Francesco Landi, Finbarr Martin y Jean Pierre Michel entre otros.
The Special Interest Group of the European Sarcopenia Working Group
perteneciente a la Sociedad de Geriatría de la Unión Europea reconocido en el año 2010 con sede en Roma y liderado por el Dr. Maurizio Muscaritoli.
The International Working Group on Sarcopenia reconocido en el año
2011 con sede en USA y liderado por los doctors Roger Fielding y William
Evans.
En el año 2012 el EWGSOP y the International Working Group on Sarcopenia
conforman The International Sarcopenia Initiative – ISI liderados por:
Alfonso Cruz-Jentof (España)
Tommy Cederholm (Suecia)
Hidenori Arai (Japón)
Yves Boirie (Francia)
Liang-Kun Chen (Taiwán)
Roger Fielding (USA)
Francesco Landi (Italia)
Finbarr Martin (UK)
Jean-Pierre Michel (Suiza)
Stéphane Schneider (Francia)
Cornel Sieber (Alemania)
Jeffrey Stout (USA)
Stefanie Studenski (USA)
Bruno Vellas (Francia)
Jean Woo (Hong Kong)
Mauro Zamboni (Italia)
Carlos Zúñiga (México)
Cuya principal función fue realizar una revisión sistemática con la evidencia
clínica publicada para definir la prevalencia y efectos de la intervención
nutricional y el ejercicio bajo la definición propuesta por el EWGSOP y
publicada en el 2014 en la revista Age and Ageing.
Definición de SARCOPENIA

Doctor William J. Evans PhD Zoologo – Biologo. Adjunct Professor in the geriatric program at the Duke University. President, Muscle & Health Division, KineMed, Inc. (Enfocado en la ingesta de proteínas en sarcopenia) Desde 1982 trabaja en la rehabilitación geriátrica en la Universidad de Arkansas y Tuft.
En el año 1995, el profesor William J. Evans del programa de geriatría de la Universidad de Duke en Carolina del Norte, perteneciente al “International Working Group on Sarcopenia” consideró la “Sarcopenia” como un síndrome geriátrico, por su asociación con el envejecimiento, en el cual hay una pérdida progresiva de la masa muscular y por lo tanto de la fuerza y del desempeño.(3)
El profesor Mattew J. Delmonico, publicó en el año 2007 en la Revista de la Sociedad Americana de Geriatría una definición alternativa de la Sarcopenia como: “un síndrome caracterizado por la pérdida progresiva y generalizada de la masa muscular esquelética y de la fuerza con incremento del riesgo de discapacidad física, enfermedades crónicas no trasmisibles, reducción de la calidad de vida y muerte” (3,4), acogida por el “The Special Interest Group of the European Sarcopenia Working Group” en el año 2011.
La sarcopenia ha sido definido también como “la perdida de la masa muscular y de la fuerza que ocurre con la edad”, según The European Working Group on Sarcopenia in Older People (EWGSOP). (5,6)
Diagnostico de SARCOPENIA
Para fines de diagnóstico de la Sarcopenia se han propuesto los siguientes
criterios:
De acuerdo a los datos del estudio Epidemiologie de l’Osteoporose (EPIDOS),
un estudio prospectivo de cohorte cuyo objetivo principal era evaluar los
factores de riesgo de fractura de cadera en una población de ancianas sanas
de vivienda comunitaria, quienes recopilaron las definiciones más relevantes
de “Sarcopenia” en el 2014 encontraron:
Propuesta I
Realizada por Baumgartner quien definió sarcopenia utilizando la relación
IMMA estableciendo el umbral en dos desviaciones estándar inferiores a
la media de una población de referencia joven. El corte que define la
sarcopenia en los hombres es IMMA ≤ 7.26 kg / m2 y en las mujeres es
IMMA ≤ 5,45 kg / m2.
Propuesta II
Definición de Sarcopenia utilizando el método de los residuos propuesto
por Newman. Se obtuvo una medida de masa magra relativa (kilogramos,
kg) ajustando la masa grasa (FM, kg) además de la altura (metros, m). Los
residuos de la regresión fueron utilizados para identificar aquellos cuya
masa magra era mucho más baja o más alta que el valor predicho. Un
residuo positivo indicaría un individuo relativamente musculoso,
mientras que los valores negativos indican individuos relativamente
sarcopénicos. El percentil 20 de la distribución de residuos se utilizó como
punto de corte para la sarcopenia.
Propuesta III
Delmonico en lugar de comparar IMMA con un corte de población más
joven, los participantes fueron clasificados como sarcopénicos si su IMMA
era ≤ 5,67 kg / m2.
Propuesta IV
Realizada por “The European Working Group on Sarcopenia in Older
People” (EWGSOP). Esta definición se basa en la presencia de un IMMA
bajo utilizando los criterios de Baumgartner (≤ 7.26 kg/m2 para hombres
y 5,45 kg / m2 para mujeres) combinado con una velocidad baja de la
marcha con un umbral establecido a ≤ 0,8 m/s o/y la presencia de una
fuerza de agarre baja con un corte de 20 kg utilizando el dinamómetro de
mano.
Propuesta V
Realizada por “The Special Interest Group of the European Sarcopenia
Working Group” liderado por Muscaretoli , definieron Sarcopenia usando
el IMMA propuesto por corte de Baumgartner (≤ 7.26 kg/m2 para
hombres y 5,45 kg / m2 para mujeres) y una velocidad de marcha ≤ 0,8 m
/s.
Propuesta VI
Realizada por el “International Working Group on Sarcopenia” liderado
por Fielding y Evans, quienes definieron Sarcopenia usando el IMMA
propuesto por Delmonico (IMMA ≤ 5,67 kg / m2) con un mal desempeño
en la prueba de velocidad de la marcha. El umbral de la velocidad de la
establecida a ≤ 1 m/s.
Esta definición es bastante similar a la Propuesta V, pero el corte de
IMMA y el de velocidad de la marcha es diferente. Las participantes
fueron encuestadas por una enfermera capacitada si tenían dificultades
(no / algunos / dificultad seria) realizando varios movimientos físicos
como caminar, subir escaleras, levantarse de una silla, recoger un objeto
del piso y levantar objetos pesados. Las categorías algunas y graves
dificultades fueron agrupadas todas juntas. Se agruparon a las mujeres
con tres o más dificultades (etiquetadas como ‘dificultades de
movimiento’).
Adicionalmente a los autores referidos en el estudio EPIDOS se pueden
encontrar otros investigadores como Kim quien propone otro punto de corte
del IMMA calculado mediante DXA ((≤ 7.40 kg/m2 para hombres y 5,14 kg /
m2 para mujeres).
El paso de los años hacia la adultez mayor se asocia con una reducción de la
masa corporal magra y un aumento de la masa grasa. El músculo esquelético
y la masa ósea son los componentes principales (más no exclusivos) de la masa
corporal magra que disminuyen con la edad.
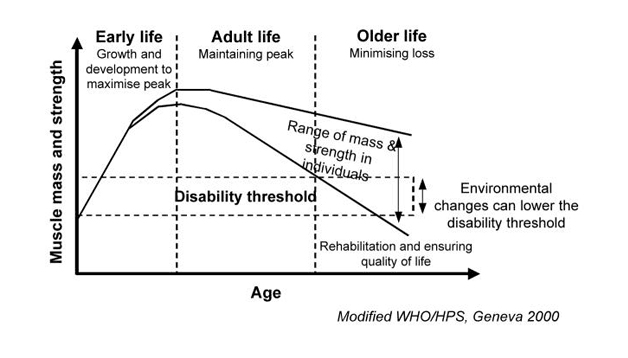
La sarcopenia comienza en la edad adulta temprana con atrofia y pérdida de
fibras musculares de tipo II y continúa durante toda la vida como resultado de la compleja interacción de causas ambientales y genéticas. La pérdida de
músculo es una característica importante en el envejecimiento: En adultos de
30 a 60 años puede esperar ganar alrededor de 0,45 kg (1 libra) de grasa y
perder alrededor de 0,23 kg (0,5 libras) de músculo al año (mioesteatosis),
siendo éste fenómeno mayor en hombres que en mujeres, consecuentemente la fuerza también disminuye (como la de agarre, que disminuye linealmente entre los 50 a los 85 años).
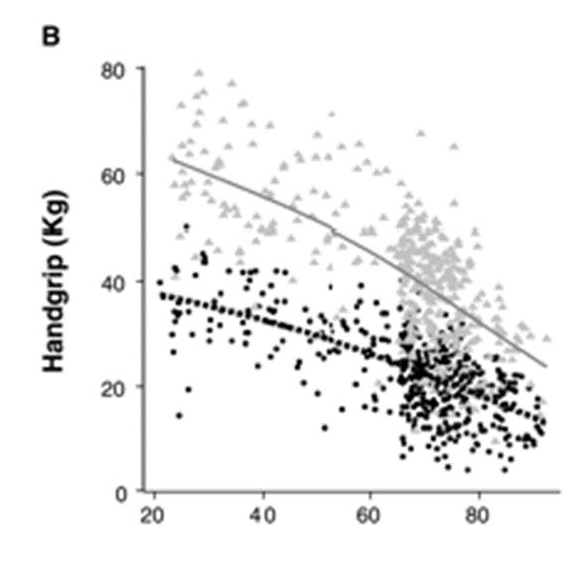
Se han propuesto diversas formas de medir la masa muscular, una con un cálculo de la sección transversal de los apéndices corporales como los brazos o las piernas mediante Resonancia Magnética, otra mediante DXA (Absorciometrìa Dual de Rayos X) que calcula de manera muy precisa la masa ósea e indirectamente la masa muscular, otra calculando la grasa corporal mediante bioimpedanciometrìa aplicando la ecuación de SIRI para densidad corporal y extrapolar la cantidad de masa libre de grasa corporal, método doblemente indirecto y hasta métodos antropométricos midiendo el perímetro de la pantorrilla. La RM y la BIM fueron validados por Janssen encontrando una excelente correlación, lo que le permitió continuar sus estudios calculando el IMME mediante bioimpedanciometrìa en más de 4000 sujetos entre hombres y mujeres y proponer un punto de corte adoptado por el “The European Working Group on Sarcopenia in Older People” (EWGSOP).

Doctor Ian Janssen PhD en epidemiología de la Actividad Física de la Universidad de Queens. Kingston, Ontario, Canadá.
Medida por absorciometria dual de rayos X (DXA)3
Tiene en cuenta el Índice de Masa Muscular Apendicular (IMMA)
IMMA= Masa muscular apendicular/ Talla2 en metros (basada en 2SD por
debajo del promedio de una población joven adulta)
Criterios de Baumgartner
Mujeres: resultado menor de 5.45 Kg/m2
Hombres: resultado menor de 7.26 Kg/m2
Criterios de Kim:
Mujeres: resultado menor de 5.14 Kg/m2
Hombres: resultado menor de 7.40 Kg/m2
IMMA: Masa muscular apendicular/Talla2 en metros (20% por debajo del
promedio de una población joven adulta)
Criterios de Delmonico
Mujeres: resultado menor de 5.67 Kg/m2
Hombres: resultado menor 7.23 kg/m2
Media por Bioimpedanciometria (BIA)
Datos para bioimpedanciometro tetrapolar en posición supina.
Tiene en cuenta la masa muscular esquelética absoluta (no es masa
apendicular)
IMME: Masa Muscular Esquelética/Talla2 en metros (Basado en 2 SD por
debajo del promedio de una población joven adulta)
Criterios de Janssen
Mujeres: resultado menor de 5.75 Kg/m2
Hombres: resultado menor de 8.50Kg/m2
Bajo rendimiento:
La pérdida de la masa muscular conlleva a reducción de la fuerza, capacidad
funcional, tasa metabólica basal, equilibrio y coordinaciòn entre otras
funciones. La cuantificación de la disminución de la capacidad funcional o un
bajo rendimiento físico se puede realizar de múltiples maneras:
Cuantificación de la actividad física mediante encuestas o cuestionarios
Calorimetría directa (Gold Estándar)
Calorimetría indirecta
o Ergoespirometría
o Prueba de esfuerzo
Test de tolerancia al ejercicio
Test de banco
Test de caminata
Test de campo
Test de potencia
Test de coordinación
La base de la cuantificación objetiva de la capacidad funcional, es la aplicación
de una carga física conocida y la evaluación y comparación de la respuesta
fisiológica contra un varemos establecido por edad y género. El resultado final
puede ser dado en diferentes unidades dependiendo del biomarcador elegido
para el control:
Calorimetría directa: Kilocalorías producidas por el sujeto.
Ergoespirometrìa: Los Biomarcadores más utilizados son: VO2 pico en
mlO2 /K/min – METs – Kilocalorías – Frecuencia cardiaca
Test indirectos: pueden convertir sus resultados a los mismos
biomarcadores anteriores o sus tablas de normalidad están dadas en:
distancia (metros), en tiempo (segundo), en peso (kilos), velocidad
(m/seg), trabajo (julios) o potencia (vatios).
Se ha sugerido la cuantificación de la velocidad de marcha en 6 metros con
partida detenida o sin impulso así:
International Working Group on Sarcopenia menor a 1 m/seg
The European Working Group on Sarcopenia in Older People”
(EWGSOP) menor a 0.8 m/seg
The Special Interest Group of the European Sarcopenia Working Group
menor a 0.8 m/seg
Las recomendaciones del Grupo internacional de trabajo en sarcopenia en
cuanto a la utilización de los diferentes biomarcadores tanto en el diagnóstico
como en el seguimiento de la patología, va dirigida a la gran importancia de la
cuantificación de la función muscular y la capacidad funcional, por lo que es
aceptado cualquier test validado que lo consiga:
Test de marcha de los 6 minutos – 6MWT: riesgo en distancias menores
de 400 metros.
Pruebas de esfuerzo en banda o cicloergòmetro: riesgo con resultados
menores a 8 METs
Pruebas de escalón: riesgo con resultados menores a 8 METs
Short Physical Performance Batery -SPPB-
o Prueba de equilibrio: riesgo con resultados menores de 1 punto
o Prueba de velocidad de marcha: riesgo con resultados menores
de 2 puntos
o Prueba de levantarse de la silla: riesgo con resultados menores de
2 puntos
Get up and go Test.
Fuerza Muscular:
Existen múltiples formas de medir la fuerza muscular y se han empleado
escalas subjetivas con signos (+) cuando el músculo es capaz de contraerse,
vencer la gravedad y vencer la fuerza del examinador, hasta escalas objetivas
en las que el evaluado es capaz de vencer una resistencia o peso conocido con
halteras, discos, bandas, cauchos o poleas y técnicas mucho más sofisticadas
en la que la dinamometría se realiza de manera computarizada construyendo
curvas de torques, aceleraciones y velocidades angulares. Este proceso se
puede realizar en cualquier músculo o en diferentes grupos musculares que
realicen una misma función o sea sinérgicos. Es de esperar que el proceso de
desacondicionamiento muscular ocurra de manera más acentuada en los
grupos musculares menos empleados, dependiendo de manera lógica de la
dominancia del sujeto. Se puede medir la fuerza isométrica máxima mediante
dinamometría o la fuerza isotónica.
Existen test que miden la capacidad para sostener una carga en el tiempo,
usualmente 1 minuto en la cual se realizan repeticiones de movimientos con
autocargas de grupos musculares importantes como los abdominales, flexo-
extensores de hombro y codo y flexo extensores de rodilla y cadera.
Teniendo en cuenta que los grupos investigadores de sarcopenia son
“Geriatras” y “Gerontólogos” e iniciaron sus estudios en poblaciones de
adultos mayores, el test elegido desde entonces fue la medición de la fuerza
de aprensión del mano medido con un dinamómetro, cuyos puntos de corte
fueron:
Hombre anormal < 30 Kg
Mujer anormal < 20 Kg
Comenzando a la edad de los 30 años los individuos pierden 1% de su masa
muscular cada año y a la edad de 80 años, se ha perdido entre 30 a 50% de la
masa muscular. Esto hace que la prevalencia esté estimada entre el 10 al 25%
dependiendo de la población y del método usado para medirla, y en los
octogenarios la prevalencia es casi del 50% 4.
Fuerza Muscular:
Existen múltiples formas de medir la fuerza muscular y se han empleado escalas subjetivas con signos (+) cuando el músculo es capaz de contraerse, vencer la gravedad y vencer la fuerza del examinador, hasta escalas objetivas en las que el evaluado es capaz de vencer una resistencia o peso conocido con halteras, discos, bandas, cauchos o poleas y técnicas mucho más sofisticadas en la que la dinamometría se realiza de manera computarizada construyendo curvas de torques, aceleraciones y velocidades angulares. Este proceso se puede realizar en cualquier músculo o en diferentes grupos musculares que realicen una misma función o sea sinérgicos. Es de esperar que el proceso de desacondicionamiento muscular ocurra de manera más acentuada en los grupos musculares menos empleados, dependiendo de manera lógica de la dominancia del sujeto. Se puede medir la fuerza isométrica máxima mediante dinamometría o la fuerza isotónica.
Existen test que miden la capacidad para sostener una carga en el tiempo,
usualmente 1 minuto en la cual se realizan repeticiones de movimientos con autocargas de grupos musculares importantes como los abdominales, flexo-
extensores de hombro y codo y flexo extensores de rodilla y cadera. Teniendo en cuenta que los grupos investigadores de sarcopenia son
“Geriatras” y “Gerontólogos” e iniciaron sus estudios en poblaciones de
adultos mayores, el test elegido desde entonces fue la medición de la fuerza de aprensión del mano medido con un dinamómetro, cuyos puntos de corte fueron:
Hombre anormal < 30 Kg
Mujer anormal < 20 Kg
Comenzando a la edad de los 30 años los individuos pierden 1% de su masa
muscular cada año y a la edad de 80 años, se ha perdido entre 30 a 50% de la masa muscular. Esto hace que la prevalencia esté estimada entre el 10 al 25% dependiendo de la población y del método usado para medirla, y en los octogenarios la prevalencia es casi del 50% 4.
Sobre los costos al sistema Janssen y colaboradores estiman que la sarcopenia genera un exceso de gastos al sistema de atención de salud de los Estados Unidos un costo superior de $18.4 mil millones de dólares al año (año 2001), debido a la discapacidad asociada.
Aquí algunas tablas sobre la variación en incidencia y prevalencia de la entidad, las cuales varían por la falta de unificación de criterios diagnósticos, aún con el trabajo de los grupos mundiales.
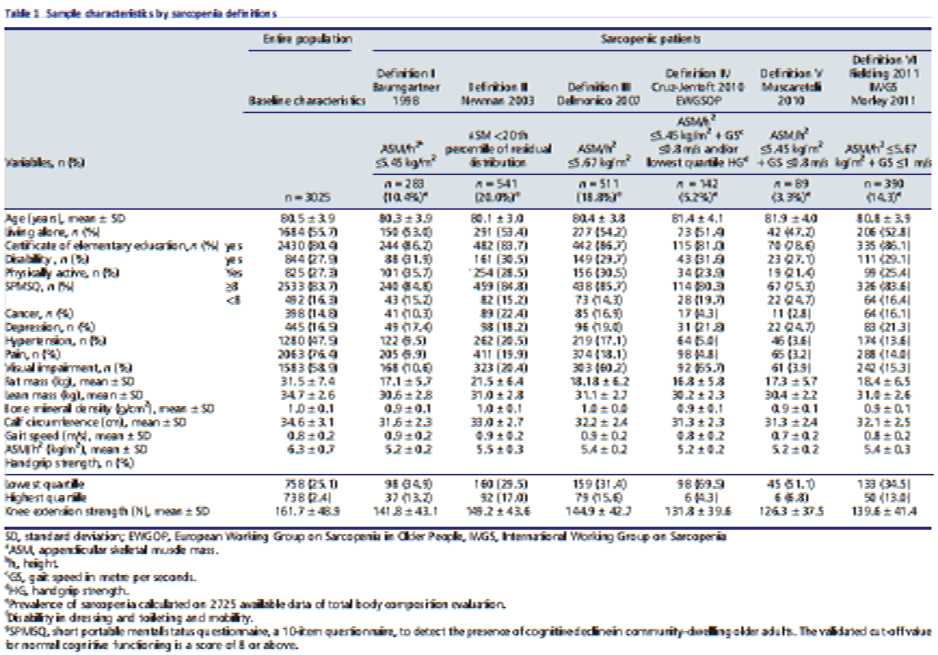
A. J. Cruz-Jentoft et al. Rev Esp Ger y Ger, 2011
En Bogotá Samper y colaboradores (2016) encontraron una prevalencia de 11.5% en la población adulta mayor utilizando otros criterios diagnósticos.
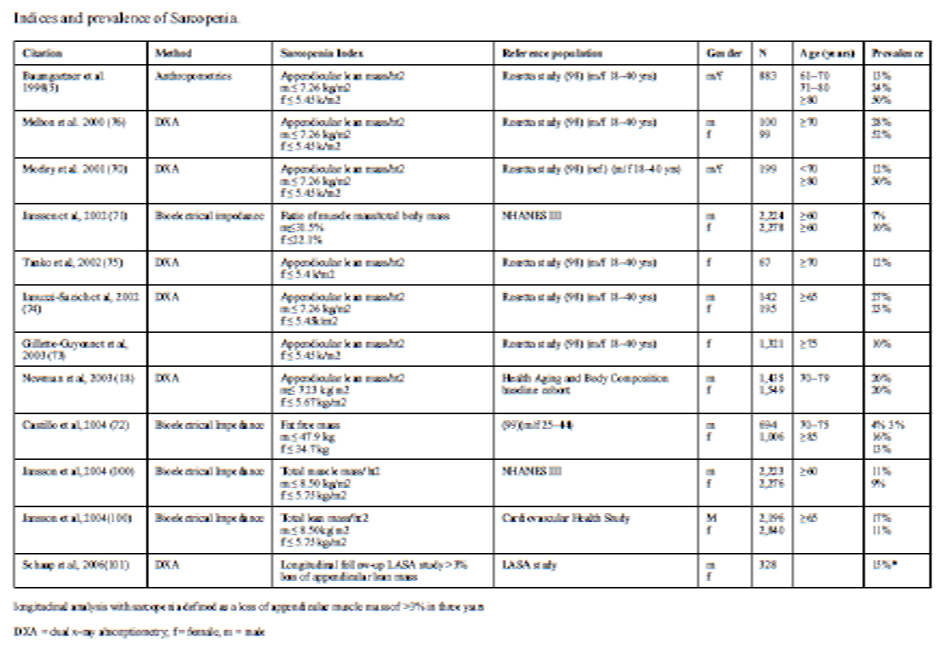
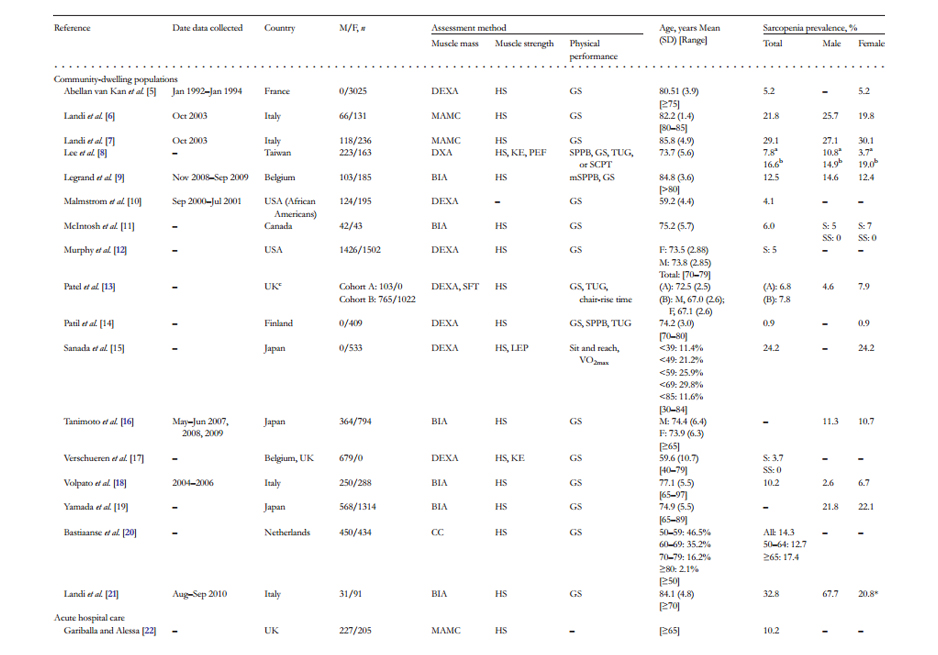
De acuerdo al estudio EPIDOS, la prevalencia se extendió de 3,3 (IC del
95%, 2,6-4, Propuesta V de Muscaretoli) -20,0% (IC del 95%, 17,3-20,3,
Propuesta III de Delmonico), Existe una gran superposición entre las seis
definiciones, pero sólo 85 participantes (3,1%) coinciden con las seis
definiciones de Sarcopenia.
Fisiológicamente se caracteriza por ser una entidad multifactorial,
presentando un amplio sustrato de situaciones precipitantes y usualmente
(más no únicamente) asociado a los cambios de la adultez mayor,
representada en el siguiente esquema:
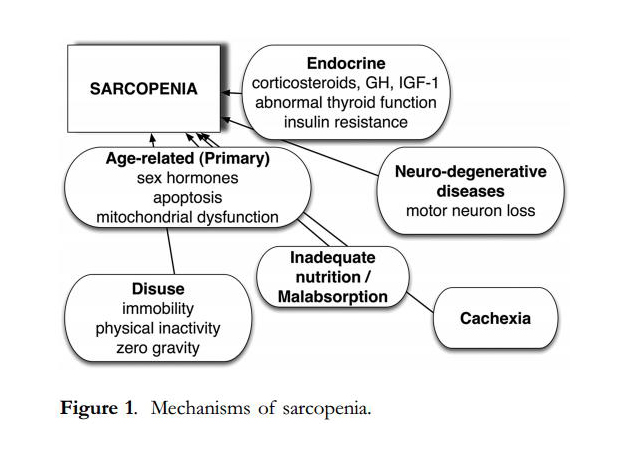
A. J. Cruz-Jentoft et al. Rev Esp Ger y Ger, 2011
Lo que varía según el grupo etáreo:
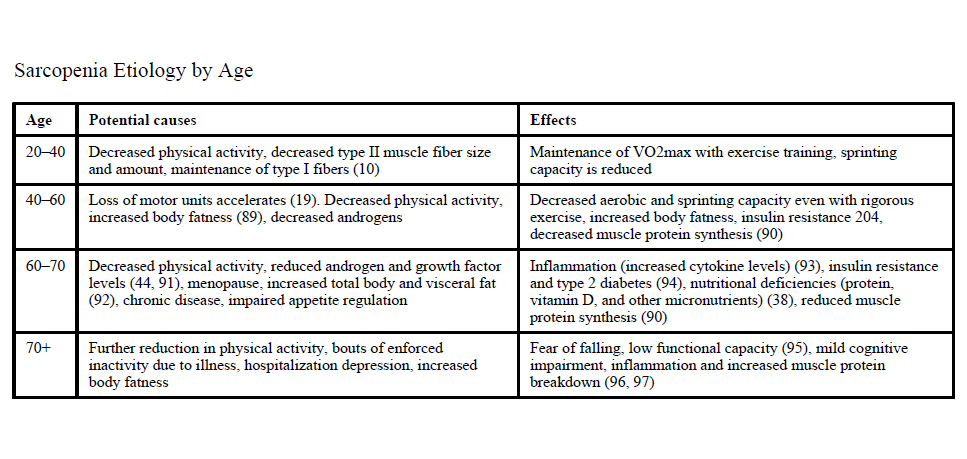
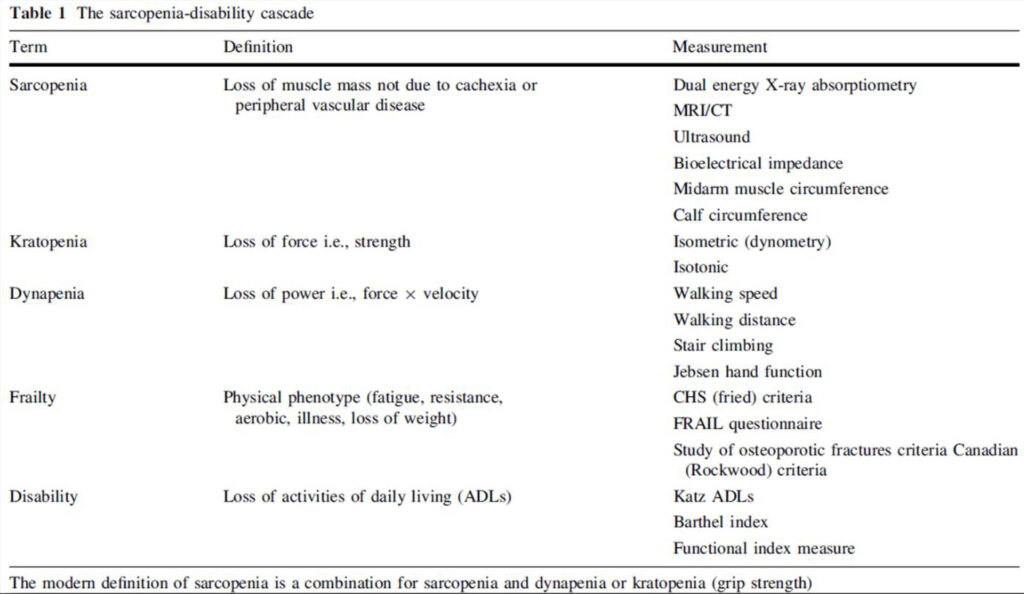
La cascada clínica de la enfermedad se ha descrito de la siguiente manera:

A. J. Cruz-Jentoft et al. Rev Esp Ger y Ger, 2011
De manera que se perpetúa la entidad en una mecánica de bola de nieve:
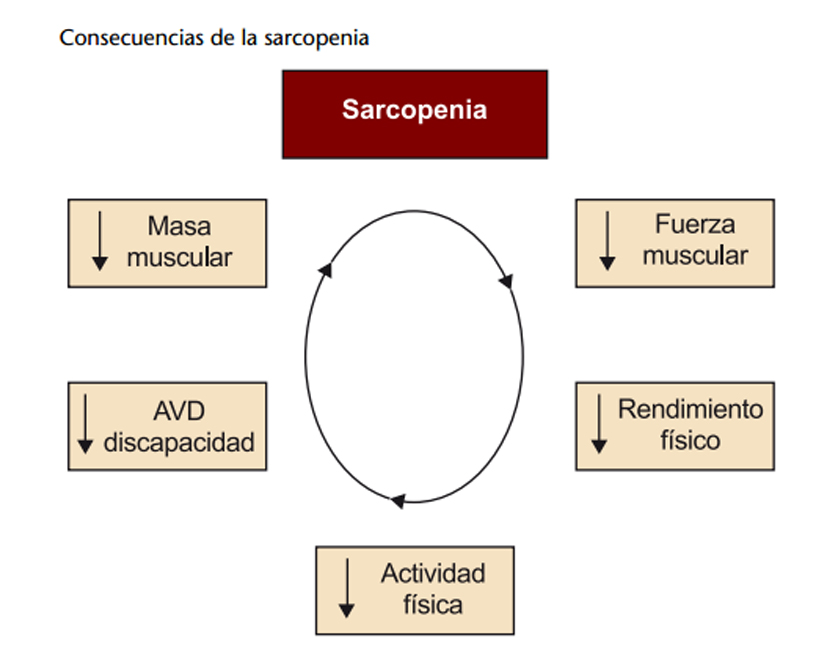
Con los avances que se realizan progresivamente en la tecnología, se ha podido realizar una ampliación sobre los fenómenos bioquímicos que facilitan o dificultan el desarrollo de la entidad, Morley y colaboradores han estudiado el esquema bioquímico de la sarcopenia (esquema adelante), ésta entidad resulta de una disminución desproporcionada en la síntesis de proteínas del músculo esquelético y / o un aumento de la degradación de proteínas del músculo esquelético. Las hormonas anabólicas y la actividad muscular conducen el sistema mediante la activación del sistema fosfatidilinositol 3 quinasa / AKT serina-treonina quinasa. Mayor disponibilidad de aminoácidos, en particular, aminoácidos de cadena ramificada estimulan mTOR. Este sistema estimula la síntesis de proteína muscular a través de la activación de la diana de mamífero de la rapamicina (mTOR) e inhibe la atrofia fosforilando la proteína FOXO. La FOXO fosforilada se inactiva por lo tanto reduce la expresión de la ligasa E3, atrogina I y, posteriormente, previene de la degradación de proteínas por el sistema de ubiquitina-proteasoma. Una mayor expresión de MuRF-1 y atrogina-1 de expresión se ha observado en el músculo de roedor de edad en comparación con joven junto con un nivel de 90% más alto de conjugados de ubiquitina. Los niveles elevados de angiotensina II inhiben la fosforilación de FOXO y estimulan la caspasa 3, que escinde actomiosina, permitiendo que la actina y la miosina a ser degradados por el sistema de ubiquitina –proteasoma. Los glucocorticoides inhiben la actividad de AKT. La miostatina D inhibe el ciclo celular a través de SMAD3 y MyoD, inhibiendo así la producción de células satélite mientras que la testosterona aumenta la producción de células satélite mediante la estimulación de β- catenina. Las citoquinas causan la fragmentación del ADN y la apoptosis mediante la estimulación de NFkB para producir la caspasa 8. Hay pocos datos comparando la expresión de factores de músculo esquelético humano afectan a la expresión del sistema ubiquitina-proteasoma, un reciente estudio examinó las características basales de las mujeres jóvenes (23 ± 2y) y mayores (85 ± 1a), así como su respuesta a un ejercicio de resistencia. Al inicio del estudio, las mujeres mayores expresaron FOXO3A y MuRF-1 genes en niveles más altos que lo hizo a las mujeres jóvenes. En respuesta a una serie de ejercicios de resistencia a todas las mujeres demostraron un aumento sustancial en la expresión de MuRF-1, sin embargo, las mujeres de edad también mostraron una mayor expresión de atrogina-1, indicando tal vez una mayor respuesta proteolítica músculo al hacer ejercicio.
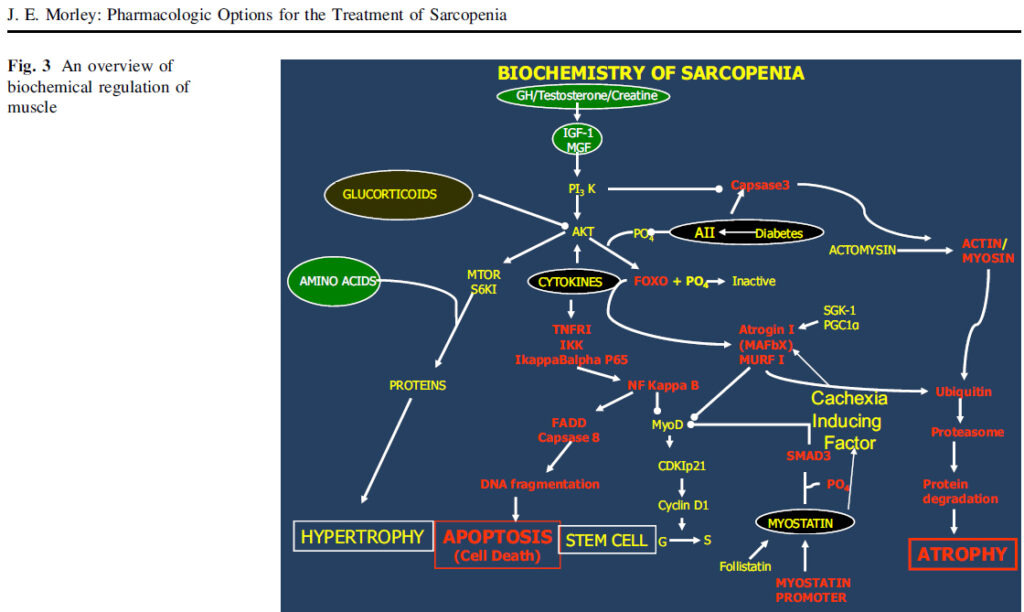
Los médicos deben sospechar la Sarcopenia en los pacientes que presentan:
De acuerdo al estudio EPIDOS CON Respecto a las diferentes dificultades
autoinformadas en la función física, el 3,7% coincidió con dificultades
para caminar, el 40,9% tiene dificultad en subir escaleras, el 51,2% tiene
dificultades en escaleras descendentes, el 39,5% tiene problemas de silla
y el 48,5% tiene más de tres dificultades. El poder predictivo de cada
modelo de referencia varió entre 68% y 81%. Todas las definiciones de
sarcopenia se asociaron significativamente con estos elementos
«escaleras descendentes» y «dificultades de movimiento».
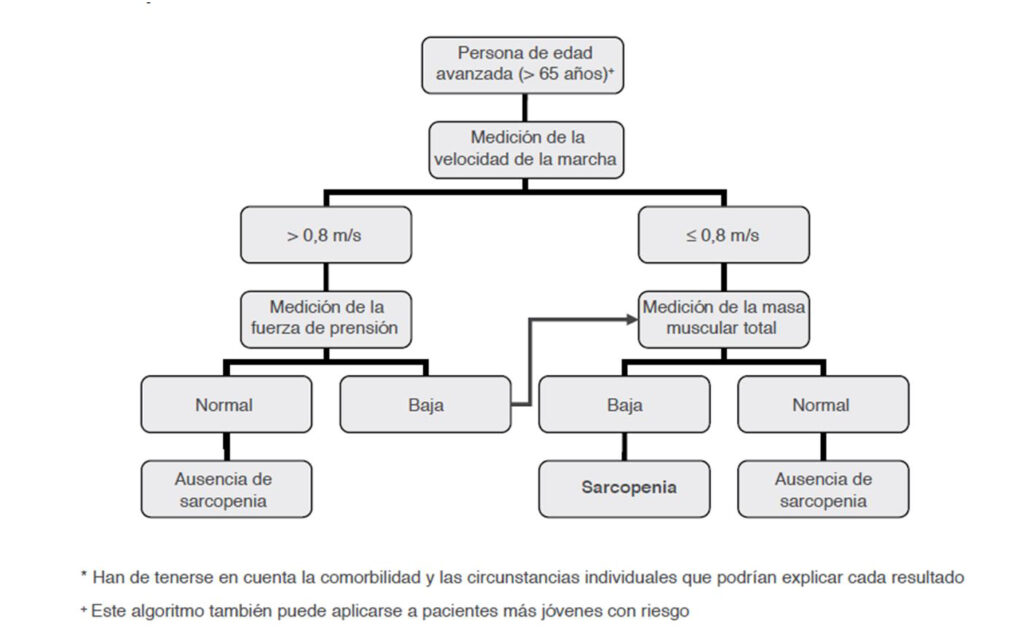
Los criterios de diagnóstico se acuñan en 3 grupos:

Y el esquema de diagnóstico hasta el momento ha sido el siguiente:
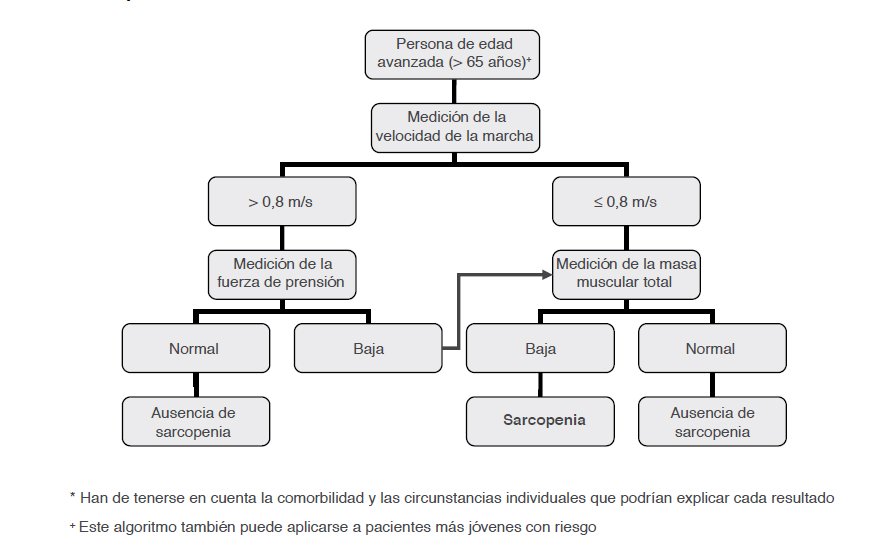
Alfonso J. Cruz Jentoft, Jean Pierre BAeyens, Jurgen Bauer. Sarcopenia: consenso europeo sobre su definición y diagnóstico. Informe del Grupo Europeo de trabajo sobre sarcopenia en adulto mayor. Age and Ageing. 2010; 39 (4): 412-423
Los indicadores de composición corporal se acuñan en la siguiente tabla:
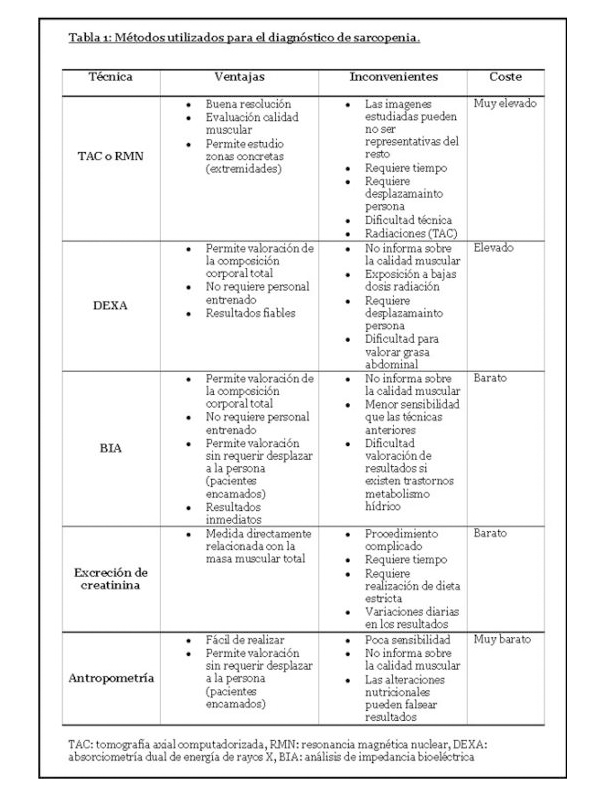
Autor: Lopez-Soto A, Masanés F. Curso de actualización en Sarcopenia. Diagnóstico y puntos de corte, Mayo-Julio/2011
Pudiendo realizar una diversificación del diagnóstico de acuerdo al escenario clínico presentado, resumido de la siguiente manera:
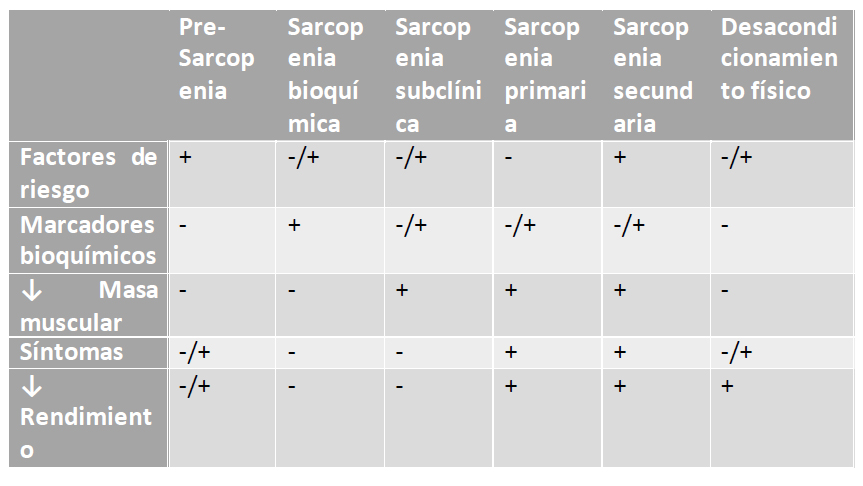
El estudio EPIDOS permite entender que las medidas de rendimiento
físico y de masa parecen no ser más relevantes que la definición basada
en la masa muscular sólo en la predicción de dificultades físicas. Ninguna
de las seis definiciones de sarcopenia exploradas parecía superior a la
otra. En otras palabras, la sarcopenia, cualquiera que sea la definición
utilizada, no mejoró significativamente la predicción de las dificultades
físicas autoinformadas.
La “Sarcopenia” un síndrome caracterizado por la pérdida progresiva y
generalizada de la cantidad y la calidad de masa muscular esquelética con
incremento del riesgo de discapacidad física, enfermedades crónicas no
transmisibles, reducción de la calidad de vida y muerte.
La sarcopenia es una condición prevenible y reversible.
Se considera “Sarcopenia primaria”, aquella pérdida muscular producto
exclusivamente del envejecimiento y “Sarcopenia secundaria” la pérdida
muscular como consecuencia de la inactividad física o enfermedad que
impacte en la estructura o metabolismo muscular o condiciones que altere el adecuado aporte nutricional.
Son causas de Sarcopenia secundaria:
Por inactividad física
o Sedentarismo
o Desacondicionamiento físico
o Reposo en cama o postración
Por enfermedad
o Enfermedades inflamatorias
o Neoplasias
o Enfermedades endocrinas
o Enfermedades neurodegenerativas
o Fracaso orgánico avanzado
Por aporte nutricional
o Dieta inadecuada
o Enfermedades digestivas
o Malabsorción
o Anorexia por fármacos
Teniendo en cuenta que la Sarcopenia posee dos componentes estrechamente
relacionados, pero no directamente proporcionales como son la cantidad de
músculo y su calidad y que adicionalmente la presencia de síntomas es un
estadio tardío de pérdida de la función, es posible encontrar grados, tipos oniveles de sarcopenia.
Presarcopenia: condición de salud anterior a la aparición de la sarcopenia, en la cual existen factores de riesgo o causas de sarcopenia secundaria, se evidencia pérdida de la masa muscular pero la calidad del músculo es aceptable para la edad. Pueden expresarse síntomas, pero no se evidencian biomarcadores húmedos ni secos para función muscular.
Sarcopenia Subclínica: condición de salud en la cual existen factores de riesgo o causas de sarcopenia secundaria y síntomas de pobre calidad muscular que se evidencian mediante biomarcadores secos o criterios de alteración de la función mecánica o metabólica del músculo y biomarcadores húmedos sin el hallazgo de pérdida de masa muscular.
Sarcopenia Bioquímica: estado de salud en la que existen factores de riesgo o causas de sarcopenia secundaria, síntomas de pobre calidad muscular con evidencia de biomarcadores húmedos o bioquímicos, pero sin evidencia objetiva de pérdida de masa muscular o reducción de la calidad del músculo.
FACTORES DE RIESGO:
Edad: Mayores de 65 años
Habito nutricional: Dieta baja en proteína < 1 g/k/dìa Hábito de actividad física: Sedentario > 8 horas/dìa sedente (1.5 METS)
Nivel de actividad física: Inactivo < 2 METS promedio hora/ dìa Antecedentes de enfermedades crónicas
Hospitalización prolongada
Historial de caídas
SINTOMAS:
Kratopenia o debilidad muscular
Dinapenia o pérdida de la potencia muscular o velocidad de ejecución
Intolerancia al ejercicio
Pérdida inexplicable de peso
BIOMARCADORES HUMEDOS
Hormona de crecimiento
Testosterona
IGF 1
Cortisol
Insulina – HOMA
CPK
Urea
Miostatina
ILK 6
BIOMARCADORES SECOS
Test de fuerza: Kilogramos – Libras – Newtons
Test de potencia: velocidad – vatios
Test de coordinación y equilibrio
Test cardiopulmonares
o VO2 màx. Consumo de oxigeno pico o máximo
o Frecuencia cardiaca máxima
o Umbral aeróbico / anaeróbico
o Umbral ventilatorio
Las características propias de los componentes diagnósticos de la sarcopenia,
como su método de cuantificación permiten que se puedan medir
objetivamente por separado y serán clasificadas como criterios diagnósticos.
Son criterios diagnóstico mayores los relacionados a la masa muscular y
criterios diagnósticos menores los relacionados con la función; dentro de esta
categoría se determinó definir criterios diagnósticos menores tipo A que
correspondela cuantificación de la función mecánica y metabólica del músculo
a partir de biomarcadores secos o alteración de la estructura o arquitectura
muscular de acuerdo a la biopsia muscular y criterios diagnósticos menores
tipo B a la cuantificación de los diferentes biomarcadores húmedos
relacionados con la función muscular.
Ante un paciente con factores de riesgo o cualquier síntoma muscular descrito
se debe iniciar la búsqueda de caso con la batería para “Sarcopenia”.
El diagnostico de Sarcopenia se realizará con mínimo:
1 criterios MAYOR + 1 criterio MENOR A
1 criterio MAYOR + 1 síntoma + 1 criterio MENOR B
1 criterio MAYOR + 2 o más criterios MENORES B
CRITERIOS MAYORES:
La medición de la masa muscular se debe realizar de dos formas, la más rápida
y económica mediante bioimpedanciometria con aparatos tetra polares
siguiendo los criterios propuestos por Janssen para calcular el IMME o
mediante la medición de la masa muscular apendicular utilizando DXA
siguiendo los criterios propuestos por Baumgartner para calcular el IMMA:
CRITERIOS MENORES A:
El diagnóstico de Presarcopenia se realizará con:
1 criterio MAYOR + síntoma
Sin evidencia de disminución de la función / Biomarcadores (-)
El diagnóstico de Sarcopenia Subclínica se realizará con:
1 criterio MENOR + síntoma
Sin evidencia de disminución de la masa muscular
El diagnóstico de Sarcopenia Bioquímica
2 o más criterios MENORES B
Metodología, búsqueda de casos

Tratamiento: Javier Vázquez
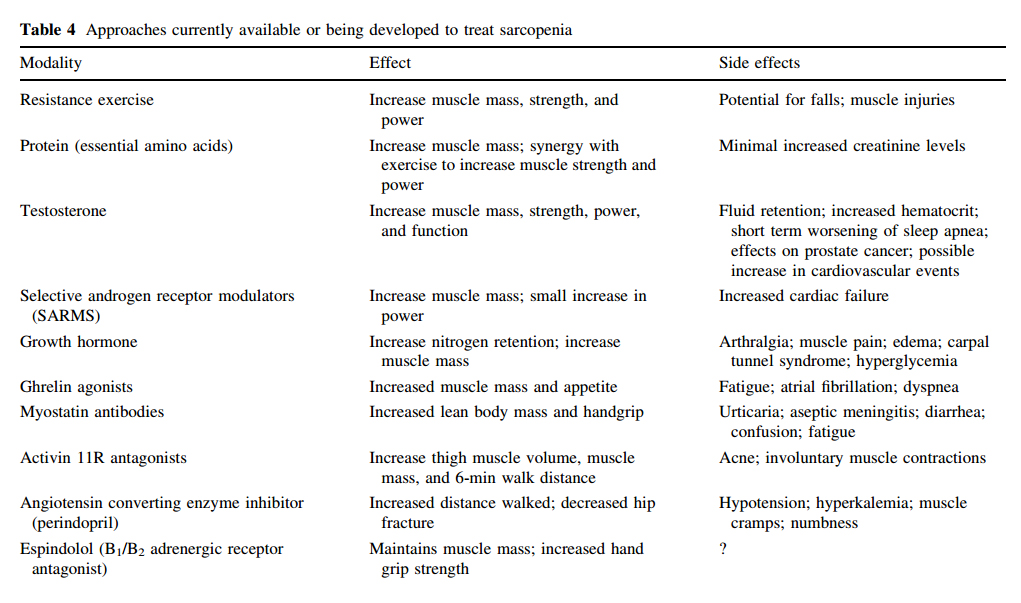
Las alternativas terapéuticas se resumen en la siguiente tabla:
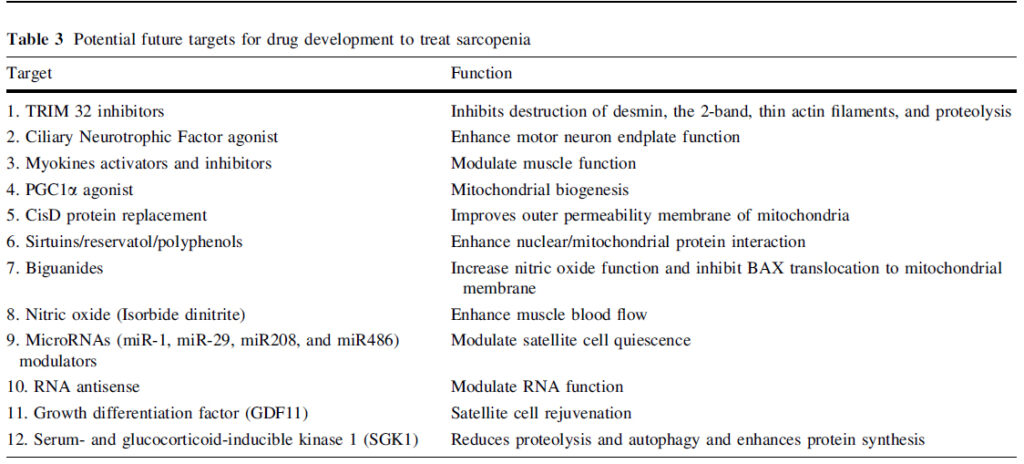
Los potenciales objetivos terapéuticos de acuerdo a su fisiopatología son:
Conclusiones: Juan Carlos Galvis
La sarcopenia representa una causa importante de discapacidad y el aumento de los costos de salud en las personas mayores. Si bien es muy común, como la mayoría de los síndromes geriátricos, pocas veces reconocido por los médicos, ahora entendiendo también que no es exclusivo de la población
adulta mayor. Identificación de pacientes sarcopénica en mayor riesgo se puede realizar utilizando una herramienta fácil de realizar la evaluación de la movilidad, como la velocidad de la marcha y las medidas comúnmente obtenidas de la composición corporal. DXA instrumentos se utilizan para
evaluar la densidad ósea para la identificación de los grupos de mayor riesgo para el desarrollo de la osteoporosis. Los avances en la instrumentación y software permiten una medida exacta y precisa de la masa libre de grasa en las personas de edad avanzada. Las personas mayores (>65 años) deben ser examinadas para tamizaje: la disminución de la masa muscular y baja capacidad funcional. Estas personas tienen un alto riesgo de pérdida de la independencia y la muerte prematura. Una serie de tratamientos prometedores para la sarcopenia están actualmente bajo investigación incluyendo la actividad física, las terapias nutricionales, terapia con andrógenos, y otras estrategias conductuales y farmacológicas. Sin embargo, hasta las organizaciones profesionales, y los Centros especializados para la atención en salud reconozcan la sarcopenia como una entidad/condición clínica su identificación, tratamiento y el desarrollo continuo de posibles agentes «anti-sarcopenia» será limitado.
Bibliografía
Doctor Irving H. Rosemberg MD Universidad de Harvard – Internista y Gastroenteròlogo, Actualmente Profesor de la Universidad Jean Mayer de la Universidad de Tufts, Profesor de Nutriciòn de la Escuela Frietman de Nutriciòn, Cientìfico Senier y Director Interino del Laboratorio de Neurociencias y Envejecimiento. irwin.rosenberg@tufts.edu (617)6363701
Doctor William J. Evans PhD Zoologo – Biologo. Adjunct Professor in the geriatric program at the Duke University. President, Muscle & Health Division, KineMed, Inc. (Enfocado en la ingesta de proteínas en sarcopenia) Desde 1982 trabaja en la rehabilitación geriátrica en la Universidad de Arkansas y Tuft.
Doctor Richard N Baumgartner PhD in Nutritional Epidemiology from University of Texas (1982). The principal investigator in “New Mexico aging process study” (1998-2004). Actualmente Profesor of epidemiology of University Lousville.
Doctora Anne B. Newman Geriatric of Presbyterian University Hospital, Pittsburgh. Public
Health Public.
Doctor Alfonso J. Cruz-Jentof Mèdico geriatra de la Universidad Complutense de Madrid.
Director de la unidad de geriatrìa del Hospital Ramòn y Cajal.